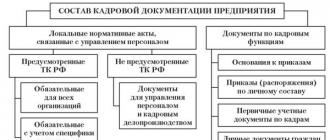
Планетарную модель атома предложил Э. Резерфорд в 1910 году. Первые исследования структуры атома были сделаны им при помощи альфа-частиц. На основе результатов, полученных в экспериментах по их рассеянию, Резерфорд предположил, что весь положительный заряд атома сосредоточен в крошечном ядре в его центре. С другой стороны, отрицательно заряженные электроны распределены внутри всего остального его объема.
Немного предыстории
Первую гениальную догадку о существовании атомов сделал древнегреческий ученый Демокрит. С тех пор идея о существовании атомов, комбинации которых дают все окружающие нас вещества, не покидала воображения людей науки. Периодически к ней обращались различные ее представители, но до начала XIX века их построения были всего лишь гипотезами, не подкрепленными опытными данными.
Наконец, в 1804 году, более чем за сто лет до того как появилась планетарная модель атома, английский ученый Джон Дальтон представил доказательства его существования и ввел понятие атомного веса, явившееся его первой количественной характеристикой. Как и его предшественники, он представлял атомы мельчайшими частями материи, похожими на твердые шарики, которые не могут быть разделены на еще более мелкие частицы.
Открытие электрона и первая модель атома
Прошло почти целое столетие, когда, наконец, в конце XIX века также англичанин Дж. Дж. Томсон открыл первую субатомную частицу, отрицательно заряженный электрон. Поскольку атомы электрически нейтральны, Томсон думал, что они должны состоять из положительно заряженного ядра с электронами, разбросанными по его объему. Основываясь на различных результатах, полученных экспериментально, он в 1898 году предложил свою модель атома, иногда называемую «сливы в пудинге», потому что атом в ней представлялся в виде сферы, заполненной некоторой положительно заряженной жидкостью, в которую электроны были внедрены, как «сливы в пудинг». Радиус такой сферической модели был около 10 -8 см. Общий положительный заряд жидкости симметрично и равномерно сбалансирован отрицательными зарядами электронов, как показано на рисунке ниже.
Эта модель удовлетворительно объясняла то обстоятельство, что при нагревании вещества оно начинает излучать свет. Хотя это была первая попытка понимания того, что же такое атом, она не смогла удовлетворить результатам экспериментов, выполненных позже Резерфордом и другими. Томсон в 1911 году согласился, что его модель просто не может ответить, как и почему происходит наблюдаемое в опытах рассеяние α-лучей. Поэтому она была оставлена, а на смену ей пришла более совершенная планетарная модель атома.
Как же все таки устроен атом?
Эрнест Резерфорд дал объяснение явления радиоактивности, которое принесло ему Нобелевскую премию, однако его наиболее значительный вклад в науку был сделан позднее, когда он установил, что атом состоит из плотного ядра, окруженного орбитами электронов, подобно тому, как Солнце окружено орбитами планет.

Согласно планетарной модели атома, большая часть его массы сконцентрирована в крошечном (по сравнению с размерами всего атома) ядре. Электроны двигаются вокруг ядра, путешествуя с невероятной скоростью, но большая часть объема атомов является при этом пустым пространством.
Размер ядра настолько мал, что его диаметр в 100 000 раз меньше, чем у атома. Диаметр ядра была оценен Резерфордом как 10 -13 см, в отличие от размера атома - 10-8 см. За пределами ядра электроны вращаются вокруг него с высокими скоростями, в результате чего возникают центробежные силы, уравновешивающие электростатические силы притяжения между протонами и электронами.
Опыты Резерфорда
Планетарная модель атома возникла в 1911, после знаменитого эксперимента с золотой фольгой, позволившего получить некоторые фундаментальные сведения о его строении. Путь Резерфорда к открытию атомного ядра является хорошим примером роли творчества в науке. Его поиски начались еще в 1899 году, когда он обнаружил, что некоторые элементы испускают положительно заряженные частицы, которые могут проникать через что угодно. Он назвал эти частицы альфа (α) частицами (теперь мы знаем, что они были ядрами гелия). Как и все хорошие ученые, Резерфорд был любопытен. Он задавался вопросом, можно ли использовать альфа-частицы, чтобы узнать структуру атома. Резерфорд решил нацелить луч альфа-частиц на лист очень тонкой золотой фольги. Он выбрал золото, потому что из него можно получать листы толщиной всего 0,00004 см. За листом золотой фольги он поставил экран, который светился, когда альфа-частицы ударяли в него. Его использовали для обнаружения альфа-частиц после их прохождения через фольгу. Небольшая прорезь в экране позволяла лучу альфа-частиц достичь фольги после выхода из источника. Часть из них должна пройти сквозь фольгу и продолжать двигаться в том же направлении, другая их часть должна отскакивать от фольги и отражаться под острыми углами. Вы можете увидеть схему эксперимента на рисунке ниже.

Что же получилось в опыте Резерфорда?
Исходя из модели атома Дж. Дж. Томсона, Резерфорд предполагал, что сплошные области положительного заряда, заполняющие весь объем золотых атомов, будут отклонять или сгибать траектории всех альфа-частиц, когда они проходят через фольгу.
Однако подавляющее большинство альфа-частиц прошло прямо через золотую фольгу, как будто ее и не было. Казалось, они проходят через пустое пространство. Лишь немногие из них отклоняются от прямого пути, как и предполагалось вначале. Ниже приведен график зависимости количества частиц, рассеянных в соответствующем направлении, от угла рассеяния.

Удивительно, но крошечный процент частиц возвращался от фольги, как баскетбольный мяч отскакивает от щита. Резерфорд понял, что эти отклонения были результатом прямого столкновения между альфа-частицами и положительно заряженными компонентами атома.
Ядро занимает центральное место
Исходя из ничтожного процента отразившихся от фольги альфа-частиц, можно сделать вывод, что весь положительный заряд и практически вся масса атома сосредоточены в одной маленькой области, а в остальной части атома в основном находится пустое пространство. Резерфорд назвал площадь концентрированного положительного заряда ядром. Он предсказал и вскоре обнаружил, что оно содержит положительно заряженные частицы, которые он назвал протонами. Резерфорд предсказал существование нейтральных атомных частиц, называемых нейтронами, но он не смог обнаружить их. Тем не менее его ученик Джеймс Чедвик открыл их через несколько лет. На рисунке ниже показана структура ядра атома урана.

Атомы состоят из положительно заряженных тяжелых ядер, окруженных вращающимися вокруг них отрицательно заряженными чрезвычайно легкими частицами-электронами, причем на таких скоростях, что механические центробежные силы просто балансируют их электростатическое притяжение к ядру, и в этой связи якобы обеспечивается стабильность атома.
Недостатки этой модели
Основная идея Резерфорда относилась к идее малоразмерного атомного ядра. Предположение об орбитах электронов было чистой гипотезой. Он не знал точно, где и как электроны вращаются вокруг ядра. Поэтому планетарная модель Резерфорда не объясняет распределение электронов на орбитах.
Кроме того, стабильность атома Резерфорда была возможна только при непрерывном движении электронов по орбитам без потерь кинетической энергии. Но электродинамические расчеты показали, что движение электронов по любым криволинейным траекториям, сопровождающееся изменением направления вектора скорости и появлением соответствующего ускорения, неизбежно сопровождается излучением электромагнитной энергии. При этом, согласно закону сохранения энергии, кинетическая энергия электрона должна очень быстро израсходоваться на излучение, и он должен упасть на ядро, как схематически показано на рисунке ниже.

Но этого не происходит, так как атомы являются стабильными образованиями. Возникло типовое для науки противоречие между моделью явления и опытными данными.
От Резерфорда к Нильсу Бору
Следующий крупный шаг вперед в атомной истории произошел в 1913 году, когда датский ученый Нильс Бор опубликовал описание более детальной модели атома. Она определяла более четко места, где могут находиться электроны. Хотя позже ученые будут развивать и более изысканные атомные конструкции, но планетарная модель атома Бора была в основном правильной, и многое из нее принимается до сих пор. Она имела множество полезных приложений, например с ее помощью объясняют свойства различных химических элементов, характер спектра их излучений и строение атома. Планетарная модель и модель Бора явились важнейшими вехами, обозначившими появление нового направления в физике - физики микромира. Бор получил Нобелевскую премию 1922 по физике за его вклад в наше понимание структуры атома.
Что же нового привнес Бор в модель атома?
Будучи еще молодым человеком, Бор работал в лаборатории Резерфорда в Англии. Поскольку в модели Резерфорда была слабо проработана концепция электронов, Бор сосредоточился именно на них. В результате была существенно доработана планетарная модель атома. Постулаты Бора, которые он сформулировал в своей статье «О строении атомов и молекул», вышедшей в 1913 году, гласят:
1. Электроны могут двигаться вокруг ядра только на фиксированных расстояниях от него, определяемых тем количеством энергии, которое у них есть. Он назвал эти фиксированные уровни энергетическими уровнями или электронными оболочками. Бор представлял их в виде концентрических сфер, с ядром в центре каждой из них. При этом электроны с меньшей энергией будут найдены на более низких уровнях, ближе к ядру. Те же из них, у кого больше энергии, будут найдены на более высоких уровнях, дальше от ядра.
2. Если электрон поглощает некоторое (вполне определенное для данного уровня) количество энергии, то он будет прыгать на следующий, более высокий энергетический уровень. И наоборот, если он потеряет такое же количество энергии, то вернется назад к исходному уровню. Однако электрон не может существовать на двух энергетических уровнях.
Эта идея иллюстрируются рисунком.

Энергетические порции для электронов
Модель атома Бора на самом деле является сочетанием двух различных идей: атомной модели Резерфорда с электронами, вращающимися вокруг ядра (по сути это планетарная модель атома Бора-Резерфорда), и идеи немецкого ученого Макса Планка о квантовании энергии вещества, опубликованной в 1901 году. A квант (во множественном числе - кванты) является минимальным количеством энергии, которая может быть поглощена или излучена веществом. Он является своего рода шагом дискретизации количества энергии.
Если энергию сравнить с водой и вы хотите добавить ее к материи в виде стакана, вы не можете просто залить воду непрерывной струей. Вместо этого вы можете добавить ее в небольших количествах, например, по чайной ложке. Бор считал, что если электроны могут поглощать или терять только фиксированные количества энергии, то они должны варьировать свою энергию только этими фиксированными количествами. Таким образом, они могут занимать только фиксированные энергетические уровни вокруг ядра, которые соответствуют квантованным приращениям их энергии.
Так из модели Бора вырастает квантовый подход к объяснению, что же из себя представляет строение атома. Планетарная модель и модель Бора явились своеобразными ступенями от классической физики к квантовой, являющейся основным инструментом в физике микромира, включая и атомную физику.
Первая попытка создания модели атома была предпринята Дж. Томпсоном. Он полагал, что атом – это электронейтральная система формы шара с радиусом 10 - 10 м. На рисунке 6 . 1 . 1 . показано, как одинаково распределяется положительный заряд атома, причем отрицательные электроны располагаются внутри него. Чтобы получить объяснение линейчатых спектров атомов, Томпсон тщетно пытался определить расположение электронов в атоме, для расчета частоты их колебаний в положении равновесия. Спустя время Э. Резерфорд доказал, что заданная Томсоном модель была неверна.
Рисунок 6 . 1 . 1 . Модель Дж. Томпсона .
Внутренняя структура атомов была исследована Э. Резарфордом, Э. Марсденом, Х. Гейгером еще в 1909 - 1911 годах. Было применено зондирование атома α -частицами, возникающими во время радиоактивного распада радия и других элементов. Их масса в 7300 раз больше массы электрона, а положительный заряд равняется удвоенному элементарному заряду.
В опытах Резерфорда были использованы α -частицы, имеющие кинетическую энергию 5 М э в.
Определение 1
Альфа-частицы – это ионизированные атомы гелия.
Когда было изучено явление радиоактивности, этими частицами Резерфорд уже «бомбардировал» атомы тяжелых металлов. Входящие в них электроны не могут заменить траектории α -частиц, так как имеют малый вес. Рассеяние может быть вызвано тяжелой положительно заряженной частью атома. На рисунке 6 . 1 . 2 подробно описан опыт Резерфорда.

Рисунок 6 . 1 . 2 . Схема опыта Резерфорда по рассеянию α -частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Радиоактивный источник, заключенный в свинцовый контейнер, располагается таким образом, что
α
-частицы направляются от него к тонкой металлической фольге. Рассеянные частицы попадают на экран со слоем кристаллов сульфида цинка, светящиеся от их ударов. Сцинтилляции (вспышки) можно наблюдать при помощи микроскопа. Угол φ к первоначальному направлению пучка не имеет ограничений для данного опыта.
После испытаний было выявлено, что α -частицы, проходящие через тонкий слой металла, не испытывали отклонений. Наблюдались их отклонения и на углы, превышающие 30 градусов и близкие к 180 .
Результат Резерфорда противоречил модели Томпсона, так как положительный заряд не был распределен по всему объему атома. Согласно модели Томпсона, заряд не имеет возможности создавать сильное электрическое поле, которое впоследствии отбросит α -частицы. Такое поле однородно заряженного шара максимально на его поверхности и убывает до нуля к центру.
Определение 2
При уменьшении радиуса шара с положительным зарядом атома максимальная сила отталкивания, действующая на α -частицы, по закону Кулона увеличилась бы в n 2 раз.
Если размеры α - частиц достаточно большие, тогда рассеивание может достичь угла в 180 градусов.
Определение 3
Резерфорд пришел к выводу, что пустота атома связана с наличием положительного заряда, сосредоточенного в малом объеме. Данная часть была названа атомным ядром .

Рисунок 6 . 1 . 3 . Рассеяние α -частицы в атоме Томсона (a) и в атоме Резерфорда (b) .
Резерфорд выяснил, что центр атома имеет положительно заряженное ядро с диаметром 10 - 14 - 10 - 15 м. Оно занимает 10 - 12 полного объема атома, но содержит весь положительный заряд и около 99 , 95 % его массы. Вещество, входящее в состав атома, предполагало наличие плотности p ≈ 10 15 г / с м 3 , а заряд ядра равнялся суммарному заряду электронов. Было установлено, что при взятии за 1 значение заряда электрона, заряд ядра равнялся числу из таблицы Менделеева.
Опыты Резерфорда приводили к радикальным выводам и сомнениям ученых. Используя классическое представление о движении микрочастиц, он предлагает планетарную модель атома. Ее смысл заключался в том, что центр атома состоит из положительно заряженного ядра, которое является основной частью массы элементарной частицы. Атом считается нейтральным. При наличии кулоновских сил вокруг ядра по орбиталям вращаются электроны, как показано на рисунке 6 . 1 . 4 . Электроны всегда находятся в состоянии движения.

Рисунок 6 . 1 . 4 . Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов.
Предложенная Резерфордом планетарная модель была толчком в развитии знаний о строении атома. Благодаря ей, опыты по рассеиванию α -частиц смогли объяснить. Но вопрос об его устойчивости остался открытым. Исходя из закона классической электродинамики, заряд, движущийся с ускорением, излучает электромагнитные волны, забирающие и распределяющие энергию. За время 10 - 8 с все электроны потратить всю энергию, вследствие чего упасть на ядро. Так как это не происходит, есть объяснение – внутренние процессы не выполняются согласно классическим законам.
Если вы заметили ошибку в тексте, пожалуйста, выделите её и нажмите Ctrl+Enter
Что это? Это модель атома Резерфорда. Она названа в честь британского физика новозеландского происхождения Эрнеста Резерфорда, который в 1911 году возвестил об открытии ядра. В ходе своих экспериментов по рассеянию альфа-частиц на тонкой металлической фольге он обнаружил, что большинство альфа-частиц напрямую проходили сквозь фольгу, но некоторые отскакивали. Резерфорд предположил, что в районе той небольшой области, от которой они отскакивали, находится положительно заряженное ядро. Это наблюдение привело его к описанию той структуры атома, которая с поправками на квантовую теорию принимается и сегодня. Подобно тому, как Земля вращается вокруг Солнца, электрический заряд атома сосредоточен в ядре, вокруг которого вращаются электроны противоположного заряда, а электромагнитное поле удерживает электроны на орбите ядра. Поэтому модель называется планетарной.
До Резерфорда существовала другая модель атома ― модель вещества Томпсона. В ней не было ядра, она представляла собой положительно заряженный «кекс», наполненный «изюминками» - электронами, которые в нем свободно вращались. Кстати, именно Томпсон и открыл электроны. В современной школе, когда начинают знакомиться с , всегда начинают с этой модели.
Модели атома Резерфорда (слева) и Томпсона (справа)
// wikimedia.org
Квантовая модель, которая сегодня описывает структуру атома, конечно, отличается от той, которую придумал Резерфорд. В движении планет вокруг Солнца нет квантовой механики, а в движении электрона вокруг ядра она есть. Однако понятие орбиты до сих пор осталось в теории строения атома. Но после того, как стало известно, что орбиты квантуются, то есть между ними нет непрерывного перехода, как думал Резерфорд, называть такую модель планетарной стало некорректно. Резерфорд сделал первый шаг в правильном направлении, и развитие теории строения атома пошло по тому пути, который он наметил.
Чем это интересно для науки? Эксперимент Резерфорда открыл ядра. Но все, что мы о них знаем, мы узнали после. Его теория развивалась в течение многих десятилетий, и в ней кроются ответы на фундаментальные вопросы о строении материи.
В модели Резерфорда быстро обнаружили парадоксы, а именно: если заряженный электрон вращается вокруг ядра, то он должен излучать энергию. Мы знаем, что тело, которое движется по кругу с постоянной скоростью, все равно ускоряется, потому что вектор скорости все время поворачивает. А если заряженная частица движется с ускорением, она должна излучать энергию. Это значит, что она должна практически мгновенно потерять ее всю и упасть на ядро. Поэтому классическая модель атома не до конца согласуется сама с собой.
Тогда стали появляться физические теории, которые пытались преодолеть это противоречие. Важное дополнение в модель строения атома внес Нильс Бор. Он обнаружил, что вокруг атома существует несколько квантовых орбит, по которым перемещается электрон. Он предположил, что электрон излучает энергию не все время, а только перемещаясь с одной орбиты на другую.

Модель атома Бора
// wikimedia.org
А вслед за боровской моделью атома появился принцип неопределенности Гейзенберга, который наконец объяснял, почему падение электрона на ядро невозможно. Гейзенберг обнаружил, что в возбужденном атоме электрон находится на дальних орбитах, а в момент, когда он излучает фотон, он падает на основную орбиту, потеряв свою энергию. Атом же переходит в устойчивое состояние, при котором электрон будет вращаться вокруг ядра до тех пор, пока его ничто не возбуждает снаружи. Это стабильное состояние, дальше которого электрон падать не будет.
Благодаря тому, что основное состояние атома - это устойчивое состояние, материя существует, мы все существуем. Без квантовой механики у нас вообще не было бы устойчивой материи. В этом смысле основной вопрос, который неспециалист может задать квантовой механике, - это почему все вообще не падает? Почему все вещество не собирается в точку? И квантовая механика способна ответить на этот вопрос.
Зачем это знать? В некотором смысле эксперимент Резерфорда повторился снова при открытии кварков. Резерфорд открыл, что положительные заряды - протоны - сосредоточены в ядрах. А что внутри протонов? Теперь мы знаем, что внутри протонов находятся кварки. Мы узнали это, проведя аналогичный эксперимент по глубокому неупругому рассеянию электронов на протонах в 1967 году в SLAC (Национальной ускорительной лаборатории, США).
Этот эксперимент проводился по тому же принципу, что и эксперимент Резерфорда. Тогда падали альфа-частицы, а здесь электроны падали на протоны. В результате столкновения протоны могут оставаться протонами, а могут возбудиться из-за большой энергии, и тогда при рассеянии протонов могут рождаться другие частицы, например пи-мезоны. Выяснилось, что это сечение ведет себя так, как будто внутри протонов есть точечные составляющие. Сейчас мы знаем, что эти точечные составляющие - кварки. В каком-то смысле это был опыт Резерфорда, но уже на следующем уровне. С 1967 года мы уже имеем кварковую модель. Но что будет дальше, мы не знаем. Теперь нужно что-то рассеивать на кварках и смотреть, на что они развалятся. Но это следующий шаг, пока это сделать не удается.
Кроме того, с именем Резерфорда связан важнейший сюжет из истории отечественной науки. В его лаборатории работал Петр Леонидович Капица. В начале 1930-х ему запретили выезжать из страны, и он был вынужден остаться в Советском Союзе. Узнав об этом, Резерфорд переслал Капице все приборы, которые были у него в Англии, и таким образом помог создать в Москве Институт физических проблем. То есть благодаря Резерфорду состоялась существенная часть советской физики.
1903 году Дж. Дж. Томсон , предложил модель атома, согласно которой атом представляет собой сферу, равномерно заполненную положительным электричеством. Электроны погружены в эту среду и взаимодействуют с элементами этой среды по закону Кулона (рис. 4.1, а ). Согласно этой модели атом в целом нейтрален: суммарный заряд сферы и заряда электронов равен нулю.
Спектр такого атома должен был быть сложным, но никоим образом не линейчатым, что противоречило экспериментальным данным. По модели Томсона колеблющийся электрон (осциллятор) может испускать электромагнитную волну. При отклонении электрона от положения равновесия возникают силы, которые стремятся возвратить его в положение равновесия. Благодаря этому возникают колебания электрона, которые обусловливают излучение атома.
Была предложена также модель атома, изображенная на рис. 4.1,б : атом состоял из сферы, в центре которой находилось положительно заряженное ядро, а вокруг него располагались электроны. Однако и эта модель не смогла объяснить результаты экспериментов.
Наиболее известна планетарная модель атома, предложенная английским физиком Э. Резерфордом (рис. 4.1, в).
Первые эксперименты по изучению строения атома были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909-1911 годах. Резерфорд предложил применить зондирование атома с помощью α -частиц, которые возникают при радиоактивном распаде радия и некоторых
а б в
других элементов. Эти опыты стали возможны благодаря открытию явления радиоактивности, при котором в результате естественного радиоактивного распада тяжелых элементов выделяются - частицы, имеющие положительный заряд, равный заряду двух электронов, масса - частицы в 4 раза больше массы атома водорода, т.е. они являются ионами атома гелия . Энергия -частиц, испускаемых различными тяжелыми химическими элементами, изменяется от эВ для урана до эВ для тория. Масса α -частиц примерно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В этих опытах использовались α -частицы с кинетической энергией 5 МэВ , что соответствовало их скорости около м/с .
Эти частицы бомбардировали фольги из тяжелых металлов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не изменяют траекторию α -частицы. Рассеяние, то есть изменение направления движения α -частиц, может вызвать только тяжелая положительно заряженная часть атома.
Цель опытов Резерфорда состояла в том, чтобы экспериментально проверить основные положения модели атома, предложенной Томсоном.
Схема опыта Резерфорда по рассеянию α -частиц показана на рис. 4.2.
Здесь K - свинцовый контейнер с радиоактивным веществом, Э - экран, покрытый сернистым цинком, Ф - золотая фольга, M - микроскоп. От радиоактивного источника, заключенного в свинцовый контейнер, α -частицы направлялись на тонкую металлическую фольгу. Толщина фольги составляла м (1 мкм ), что эквивалентно примерно 400 слоям из атомов золота. Рассеянные фольгой α -частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом
С помощью микроскопа. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги. Т.е. можно было всегда измерить угол отклонения α -частиц от прямолинейной траектории движения. Весь прибор помещался в вакуум, чтобы α -частицы не рассеивались при столкновении с молекулами воздуха.
Наблюдения рассеянных α -частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α -частиц проходило через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц все же отклонялась на значительные углы, превышающие 30°. Очень редкие α -частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. Этот результат был неожиданным, т.к. находился в противоречии с моделью атома Томсона, согласно которой положительный заряд распределён по всему объёму атома.
При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α -частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу по закону Кулона, возросла бы в n 2 раз. Тогда при достаточно большом значении n α -частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объёме, имеющем размеры порядка
10 -14 м . Эту часть атома Резерфорд назвал атомным ядром . Электроны, по мнению Резерфорда, движутся вокруг ядра с размерами порядка 10 -14 м . Так возникла ядерная модель атома (рис. 4.1, в ).
На основании полученных результатов Резерфорд, учитывая, что электроны атома не могут существенно влиять на рассеяние относительно тяжелых и быстрых -частиц, сделал выводы, которые были положены в основу планетарной (ядерной) модели атомов:
1) существует ядро, в котором сосредоточена вся масса атома и весь его положительный заряд, причем размеры ядра значительно меньше, чем размер самого атома;
2) электроны, которые входят в состав атома, движутся вокруг ядра по круговым орбитам.
Исходя из этих двух предпосылок и предполагая, что взаимодействие между налетающей -частицей и положительно заряженным ядром определяется кулоновскими силами, Резерфорд установил, что атомные ядра имеют размеры м , т.е. они в раз меньше размеров атомов. Ядро занимает только 10 -12 часть полного объёма атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Вещество, составляющее ядро атома, имеет колоссальную плотность ρ≈10 17 кг /м 3 . Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Величина положительного электрического заряда атомного ядра Z определяется количеством протонов в ядре (и, следовательно, количеством электронов в атомных оболочках), которое совпадает с порядковым номером элемента в периодической таблице. Заряд равен Zе , где е = 1,602 · 10 -19 Кл - абсолютная величина элементарного электрического заряда. Заряд определяет химические свойства всех изотопов данного элемента.
В 1911 Резерфорд, используя закон Кулона, получил формулу
где N - количество α -частиц, падающих в единицу времени на рассеиватель; dN - количество рассеянных в единицу времени α -частиц в телесном угле dΩ под углом θ ; Ze и n - заряд ядер рассеивателя и их концентрация; dx − толщина слоя фольги; V и m α - скорость и масса α -частиц.
Прямые опыты по измерению заряда ядер на основе формулы Резерфорда были выполнены Чедвиком в 1920 году. Схема опыта Чедвика приведена на рис. 4.3.
Рассеиватель в виде кольца (заштриховано на рис. 4.3) размещался соосно и на равных расстояниях между источником И и детектором α -частиц Д. При измерении количества dN рассеянных α-частиц отверстие в кольце закрывалось экраном, который поглощал прямой пучок α-частиц из источника
в детектор. Детектор регистрировал только α -частицы, рассеянные в телесном
угле dΩ под углом θ к падающему пучку α -частиц. Затем кольцо перекрывалось экраном с отверстием, и измерялась плотность тока α -частиц в точке расположения детектора. По полученным данным, рассчитывали количество N α -частиц, падающих на кольцо в единицу времени. Таким образом, если известна энергия α - частиц, испускаемых источником, без труда определялась величина Z в формуле (4.1).
Формула Резерфорда позволила объяснить экспериментальные результаты по рассеянию α -частиц на тяжелых ядрах, что привело к открытию атомного ядра и созданию ядерной модели атома.
Модель атома, предложенная Резерфордом, напоминает Солнечную систему. Именно поэтому модель Резерфорда получила название планетарной модели атома. Эта модель стала значительным шагом на пути к современным представлениям о строении атома. Лежащее в ее основе понятие атомного ядра, в котором сосредоточены весь положительный заряд атома и практически вся его масса, сохранило свое значение до настоящего времени.
Однако, в отличие от планетарной модели Солнечной системы, планетарная модель атома оказывается внутренне противоречивой с точки зрения классической физики. И это, прежде всего, связано с наличием у электрона заряда. Согласно законам классической электродинамики вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица, будет излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным, то есть содержать электромагнитные волны с любой длиной волны. Уже этот вывод противоречит линейчатости спектров излучения атомов, наблюдаемой на опыте.
Кроме того, непрерывное излучение уменьшает кинетическую энергию электрона. Поэтому, за счет излучения радиус орбиты движущегося электрона обязан уменьшаться, и, в конце концов, электрон должен упасть на ядро, как показывают оценки, за время . Однако в действительности атом водорода является устойчивой и «долгоживущей» электромеханической системой. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
Тема этого занятия - «Модели атомов. Опыт Резерфорда». На нём мы узнаем, как происходило изучение учеными сложной структуры атомов, как нашли объяснение этой теории, где полученные знания применяются на сегодняшний день. Также мы рассмотрим, как с помощью опыта Резерфорда можно изучить модель атома.
На предыдущем уроке мы обсудили, что в результате радиоактивности образуются различные виды излучений: a-, b-, и g-лучи. Появился инструмент, при помощи которого можно было изучать строение атома.
После того, как стало ясно, что атом тоже имеет сложную структуру, как-то по-особенному устроен, необходимо было исследовать само строение атома, объяснить, как он устроен, из чего состоит. И вот ученые приступили к этому изучению.
Первые идеи о сложном строении были высказаны Томсоном , который в 1897 году открыл электрон. В 1903 году Томсон впервые предложил модель атома. По теории Томсона, атом представлял собой шар, по всему объему которого «размазан» положительный заряд. А внутри, как плавающие элементы, находились электроны. В целом, по Томсону, атом был электронейтрален, т. е. заряд такого атома был равен 0. Отрицательные заряды электронов компенсировали положительный заряд самого атома. Размер атома составлял приблизительно 10 -10 м. Модель Томсона получила название «пудинг с изюмом»: сам «пудинг» - это положительно заряженное «тело» атома, а «изюм» - это электроны (рис. 1).
Рис. 1. Модель атома Томсона («пудинг с изюмом»)
Первый достоверный опыт по определению строения атома удалось провести Э. Резерфорду . На сегодняшний день мы твердо знаем, что атом представляет собой структуру, напоминающую планетную солнечную систему. В центре находится массивное тело, вокруг которого вращаются планеты. Такая модель атома получила название планетарной модели.
Давайте обратимся к схеме опыта Резерфорда (рис. 2) и обсудим результаты, которые привели к созданию планетарной модели.

Рис. 2. Схема опыта Резерфорда
Внутрь свинцового цилиндра с узким отверстием был заложен радий. При помощи диафрагмы создавался узкий пучок a-частиц, которые, пролетая через отверстие диафрагмы, попадали на экран, покрытый специальным составом, при попадании возникала микро-вспышка. Такое свечение при попадании частиц на экран называется «сцинтиляционная вспышка». Такие вспышки наблюдались на поверхности экрана при помощи микроскопа. В дальнейшем до тех пор, пока в схеме не было золотой пластины, все частицы, которые вылетали из цилиндра, попадали в одну точку. Когда же внутрь экрана на пути летящих a-частиц была поставлена очень тонкая пластинка из золота, стали наблюдаться совершенно непонятные вещи. Как только была поставлена золотая пластина, начались отклонения a-частиц. Были замечены частицы, которые отклонялись от своего первоначального прямолинейного движения и уже попадали в совершенно другие точки этого экрана.
Более того, когда экран сделали почти замкнутым, выяснилось, что есть частицы, которые каким-то образом летят в обратную сторону. Они отклоняются под углом 90° и больше. Эти наблюдения были проанализированы Резерфордом, и выяснилась следующая довольно любопытная вещь.
В первую очередь здесь потерпела крах теория Томсона. По теории Томсона, атом представляет собой шар размером 10 -10 м, в котором положительный заряд размазан и есть электрон. Так вот, электроны - это очень маленькие частицы, они не могут препятствовать a-частицам, летящим с приличной скоростью. Скорость a-частиц в данном случае составляла около 10000 км/с.
Представьте себе ситуацию, когда грузовик столкнется с игрушечным автомобилем. Понятно, что грузовик даже не заметит такого автомобиля. Это мы можем привести как аналогию столкновения электрона с a-частицей. Значит, необходимо было сделать вывод, что атом устроен иначе, не так, как утверждал Томсон. И, видимо, в атоме золота есть объект более массивный, чем a-частица, имеющий положительный заряд.
Давайте посмотрим еще одну картину, которая характеризует рассеивание a-частиц на той массивной частице, наличие которой предсказал Резерфорд в атоме (рис. 3).

Рис. 3. Рассеивание альфа-частиц По результатам опытов можно было говорить, что в атоме есть массивный положительно заряженный объект. a-частица, сталкиваясь с этой большой частицей, может отразиться обратно. Те частицы, которые пролетают рядом, отклоняются на разные углы. Чем дальше a-частица пролетает от этого объекта, тем на меньший угол они отклоняются. Такое явление получило название «рассеивание a-частиц ».
Крупную частицу, которая находится внутри атома, Резерфорд назвал ядром. И даже оценил его размеры. По оценке Резерфорда, размеры ядра составили 10 -14 -10 -15 м. Этот объект был очень и очень мал по своим размерам по сравнению с атомом. Атом имеет размер порядка 10 -10 м. При этом практически вся масса атома была сосредоточена именно в ядре. И именно вокруг ядра обращаются электроны.
Отсюда следует планетарная модель Резерфорда, которая утверждает, что атом представляет собой массивное положительно заряженное ядро, вокруг которого по своим орбитам обращаются электроны (рис. 4). В целом атом электронейтрален, т. е. заряд атома равен нулю. Если у атома избыток или недостаток электронов, то его называют ион.

Рис. 4. Планетарная модель атома
Конечно, были и другие теории, представляющие интерес. На сегодняшний день общепринятой, с некоторыми оговорками, о которых поговорим позднее, является именно планетарная модель атома, предложенная Эрнестом Резерфордом.
Список литературы
- Бронштейн М.П. Атомы и электроны. «Библиотечка “Квант”». Вып. 1. - М.: Наука, 1980.
- Кикоин И.К., Кикоин А.К. Физика: Учебник для 9 класса средней школы. - М.: «Просвещение».
- Китайгородский А.И. Физика для всех. Фотоны и ядра. Книга 4. - М.: Наука.
- Мякишев Г.Я., Синякова А.З. Физика. Оптика Квантовая физика. 11 класс: учебник для углубленного изучения физики. - М.: Дрофа.
- Ньютон И. Математические начала натуральной философии. - М.: Наука, 1989.
- Резерфорд Э. Избранные научные труды. Радиоактивность. - М.: Наука.
- Резерфорд Э. Избранные научные труды. Строение атома и искусственное превращение элементов. - М.: Наука.
- Эйнштейн А., Инфельд Л. Эволюция физики. Развитие идей от первоначальных понятий до теории относительности и квантов. - М.: Наука, 1965.